Module 1 – Point de décision stratégique no 1 : Développement de l’entreprise
Aperçu du module
Ce module explore la manière par laquelle une entreprise détermine les débouchés potentiels de commercialisation d’un médicament, l’affectation subséquente des ressources et la planification initiale qui sont nécessaires au stade le plus précoce du processus de lancement. Il décrit l’éventail complet des tâches qui doivent être accomplies vingt-quatre mois avant le lancement, en se concentrant sur le développement de l’entreprise.
Chaque tâche inclut :
- Son échéancier dans le processus
- La ou les équipe(s) responsable(s)
- Le résultat recherché
- Des recommandations en matière de planification
Objectifs du module
À la fin de ce module, vous serez en mesure d’expliquer :
- le rôle crucial d’une évaluation commerciale dans la décision de l’entreprise de lancer un produit;
- ce qui rend le classement de la marque essentiel à l’affectation des ressources et à la réalisation de l’excellence du lancement;
- l’importance d’une préparation rigoureuse pour s’assurer que le produit a le potentiel de réaliser un maximum de ventes;
- les diverses tâches et mesures à prendre au stade le plus précoce du processus de lancement.
POINT DE DÉCISION STRATÉGIQUE No 1 : DÉVELOPPEMENT DE L’ENTREPRISE
Les questions essentielles auxquelles il faut répondre au point de décision stratégique no 1 sont :
1. Quelle est l’importance de ce débouché?
2. Combien de ressources investissons-nous?
- Classer le nouveau produit selon son ordre de priorité
- Créer une équipe de lancement.
- Communiquer l’importance du produit au sein de l’entreprise.
- Effectuer l’analyse réglementaire du dossier.
- Évaluer les solutions de rechange favorables en matière de prix.
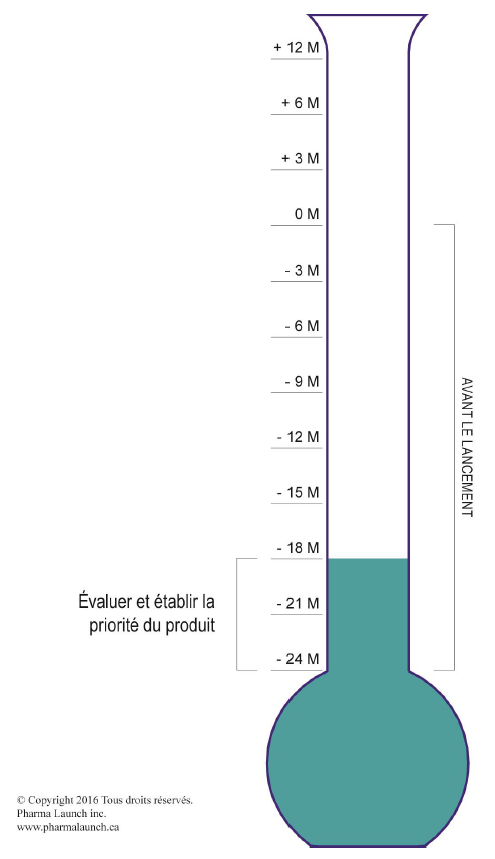
Tâches à accomplir vingt-quatre mois avant le lancement
Chaque produit de marque lancé a le potentiel d’atteindre un statut de classe mondiale. Cependant, n’importe quel produit lancé peut se révéler un échec sans une préparation soigneuse. Pfizer, une des dix plus importantes sociétés pharmaceutiques, a pour devise « les produits phares sont créés », ce qui est totalement vrai, tout comme l’est l’inverse.
L’équipe de lancement doit se fier au produit qu’elle commercialise, car il a une incidence sur la compréhension qu’en ont les clients, sur la volonté des payeurs de le payer et sur la volonté des patients de le consommer. Sans une préparation réfléchie pendant les vingt-quatre mois avant le lancement, des lacunes dans des secteurs essentiels empêcheront le produit de réaliser un maximum de ventes.
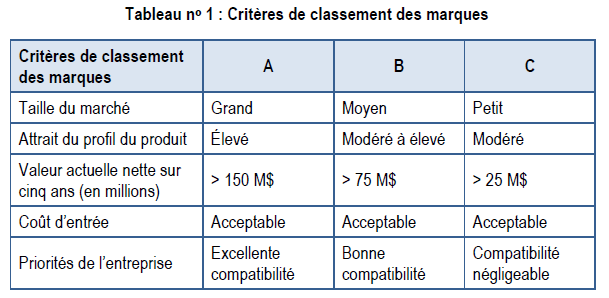
Le premier point de décision stratégique de la structure porte sur le développement de l’entreprise, lorsque l’entreprise décide des ressources à affecter à la marque selon la taille des débouchés. À ce point de décision, l’équipe effectue une évaluation commerciale des débouchés et détermine les principaux enjeux du produit. L’équipe fournit ensuite à la haute direction une évaluation du classement du produit, par exemple une priorité de marque « A », « B » ou « C ». Une marque « A » représente un gros débouché, alors qu’une marque « C » représente un moins gros débouché, mais quand même viable financièrement.
À ce stade, l’équipe se compose du DG, de membres des services des Affaires réglementaires, des Finances, du Marketing, des Affaires juridiques, de l’Accès aux marchés et de l’Analyse du marché.
Le point de décision stratégique no 1 requiert une évaluation commerciale détaillée pour établir le classement de la priorité de la marque dans l’entreprise; il est crucial de le traiter en priorité parmi les autres projets. Une marque « A », par exemple, recevrait une priorité absolue pour des ressources internes, tandis qu’une marque « C » pourrait recevoir un budget plus restreint et davantage de ressources externes. Les marques peuvent changer de classement au fil du temps à mesure que de nouveaux renseignements sont accessibles. Le classement d’une marque ne devrait pas avoir d’incidence sur la qualité de la préparation du lancement. Des critères décisionnels sont fournis ci-dessous pour tous les classements.
Le classement des marques a pour but d’assurer l’affectation des ressources qui correspond à l’ampleur des débouchés commerciaux. Une entreprise qui a trop de marques qui se livrent concurrence pour ses ressources limitées pourrait devoir disperser son personnel et ses finances. Une entreprise qui n’établit pas ses priorités risque de ne pas atteindre l’excellence du lancement d’aucune de ses marques. Il est possible que des classements plus faibles de certaines marques soient quand même d’une importance vitale pour l’entreprise, cependant, ils nécessitent des compétences et des outils différents pour atteindre le succès, par exemple le recours à des ressources contractuelles ou en partenariat.
Le classement de la priorité de chaque produit en développement permet d’établir une structure optimale. En règle générale, la structure suit la stratégie.
Réflexions de l’auteur sur les lancements
Pendant les lancements simultanés de trois marques dans une entreprise, l’établissement des priorités des lancements est devenu problématique. Lorsque nous avons évalué les produits d’un point de vue stratégique ainsi que la contribution des produits à la concentration de l’entreprise sur les produits de spécialité comparativement à la seule contribution financière sur une base annuelle, les priorités sont devenues plus claires. Deux marques étaient conformes à la concentration de l’entreprise sur les produits de spécialité et une troisième marque offrait un traitement supérieur en matière de soins primaires — un produit unique! Par conséquent, celui-ci ne méritait pas les mêmes ressources que les produits qui correspondaient au domaine de spécialité de l’entreprise. Par conséquent, malgré un niveau de priorité plus faible, le produit de soins primaires est quand même devenu le traitement numéro un de sa catégorie thérapeutique.
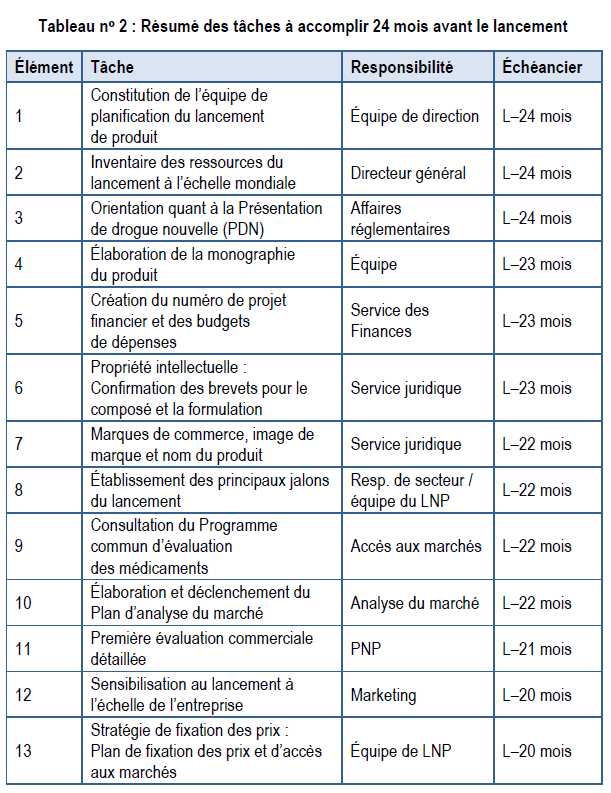
Le tableau suivant répertorie les tâches qui doivent être exécutées au stade le plus précoce du lancement, en se concentrant principalement sur le développement de l’entreprise. Cette section abordera chacune de ces tâches en détail. Le tableau énumère les groupes qui sont principalement responsables de la mise en oeuvre de chaque tâche. La dernière colonne indique l’échéancier de l’amorce de chaque tâche.
La section suivante fournit des renseignements détaillés sur les tâches recommandées pour développer l’organisation qui permettra de réaliser l’excellence du lancement.
Tâche no 1 : Constitution de l’équipe de planification du lancement de produit
Responsabilité décisionnelle : Direction de l’entreprise
Résultat recherché : Créer l’équipe multidisciplinaire de lancement.
Recommandations en matière de planification :
La première étape du processus de lancement est la réunion inaugurale au cours de laquelle la haute direction présente les membres de l’équipe et leurs principales responsabilités. Pendant cette réunion, la nouvelle équipe multidisciplinaire de Lancement du nouveau produit (LNP) évaluera les tâches à accomplir et recrutera les intervenants appropriés pour chaque tâche. La communication dès le début du processus, lorsque les nouveaux membres se joignent à l’équipe, est une étape importante du développement de l’équipe de lancement.
Les points de décision stratégiques en six étapes et les points de contrôle offrent aux membres de l’équipe un excellent aperçu des points auxquels on fera appel à leur expertise, ce qui contribue à les motiver puisqu’ils sont bien informés.
Un développement de produit réussi commence aux stades précliniques les plus précoces, avant que le produit soit transféré à la commercialisation des nouveaux produits. Le personnel de la commercialisation au stade précoce fait souvent équipe avec des représentants des services du Développement commercial, de la Recherche et Développement (R et D), ainsi que des services des Affaires médicales, Affaires réglementaires, Affaires juridiques, Affaires cliniques, de l’Approvisionnement et autres. Une liste de ces équipes et de leurs fonctions est présentée dans les deux paragraphes suivants et fournie dans l’Annexe. Les processus multidisciplinaires de développement de produit garantissent que les décisions sont bien réfléchies et que les contrepoids sont en place puisque les points de vue de toute l’entreprise sont pris en compte.
Au sein de l’équipe de LNP, un chef de produit est responsable de l’évolution rentable de la marque à court et à long terme sur le marché par le truchement d’une planification, d’une exécution, d’un contrôle et d’une formation efficaces. Le représentant des Affaires réglementaires est responsable de toutes les activités qui entourent la présentation du dossier de présentation et la réception de l’approbation de la Direction des produits thérapeutiques (DPT). Le service des Finances est chargé de tous les états financiers et des contrôles budgétaires. Les services de l’Approvisionnement et de l’Assurance de la qualité (AQ) sont responsables de fournir un produit final prêt à la vente qui respecte les bonnes pratiques de fabrication (BPF). Le responsable de l’Accès aux marchés est chargé d’obtenir l’inscription du produit dans les listes de médicaments remboursés, pour permettre à la marque d’atteindre son plein potentiel. En dernier lieu, le service des Affaires juridiques est responsable de veiller à ce que les clauses des contrats, les marques de commerce et les brevets soient en place pour maximiser le cycle de vie du produit.
Au début, maintenez une petite équipe multidisciplinaire de lancement. N’incluez que les personnes qui sont nécessaires à chaque stade de développement, en vous servant des listes de contrôle fournies ici au début de chaque stade. Il est possible de constituer plusieurs équipes ad hoc en dehors de l’équipe centrale pour des projets particuliers à court et à long terme. Des réunions doivent être planifiées une fois par mois ou toutes les deux semaines au début pour faciliter la circulation de l’information et accélérer la planification du produit. Les représentants de chaque domaine au sein de l’équipe de lancement sont responsables de la rédaction de leur section du plan.
Pour assurer au produit la meilleure chance de réussite à long terme, il est essentiel de donner la priorité au développement de l’équipe de lancement. Lorsque vous envisagez un lancement de produit et son cycle de vie, demandez l’opinion de tous les secteurs fonctionnels, et ce, que votre entreprise ait constitué une équipe multidisciplinaire de LNP ou qu’elle transmette les responsabilités de fonction à fonction. En fait, l’appropriation fonctionnelle pourrait accélérer la prise de décisions. La collaboration interfonctionnelle au sein de l’équipe de lancement assure l’accès aux connaissances et à l’expérience de nombreux services et divisions.
Tâche no 2 : Inventaire des ressources de lancement à l’échelle mondiale
Responsabilité décisionnelle : Directeur général et équipe de développement commercial
Résultat recherché : Les dossiers et les documents essentiels sont mis à la disposition de la nouvelle équipe de lancement de nouveau produit (LNP).
Recommandations en matière de planification :
Après la transmission du nouveau produit par l’équipe de développement de l’entreprise, l’équipe de commercialisation (y compris l’équipe de LNP) a le « feu vert » pour commencer à planifier. Que le nouveau produit ait été acheté ou qu’il ait été mis au point au sein de l’entreprise, l’équipe de développement de l’entreprise a investi des ressources considérables dans ses évaluations. Par conséquent, une revue approfondie de tous les dossiers de développement de l’entreprise est nécessaire afin, d’augmenter rapidement la connaissance du produit chez les membres de l’équipe de commercialisation. L’équipe de LNP a besoin d’accéder aux dossiers du processus de vérification préalable, aux hypothèses clés, aux prévisions, aux plans commerciaux, aux essais cliniques phares, aux ententes de partenariat (y inclus les feuilles de conditions), à la séquence des lancements à l’internationale, aux lignes directrices internationales de fixation des prix, aux conditions, à l’état du dossier à la Division des produits thérapeutiques (DPT), aux délais d’approvisionnement du produit, aux renseignements sur l’image de marque et la marque de commerce, aux renseignements sur la propriété intellectuelle (PI), aux plans d’analyse du marché et de gestion du cycle de vie (GCV).
Les évaluations du développement de l’entreprise sont essentielles à la compréhension des possibilités de l’équipe de LNP et servent de fondement accéléré à une planification efficace. Ces évaluations offrent un point de vue précieux sur le potentiel du produit sur le marché.
Réflexions de l’auteur sur les lancements
La transmission de tous les fichiers par l’équipe de développement commercial est importante pour comprendre le développement du produit, les débouchés prévus du marché et les accords de licences. Il est également important que l’équipe de développement commercial évalue les priorités de tous les produits en développement. Dans une entreprise, le chef de l’équipe de développement commercial croyait que le partage des dossiers du produit ne permettrait pas à l’équipe de développement de produit d’élaborer ses propres idées pour la marque. Il était plutôt convaincu que la contribution au développement des produits devrait être une initiative à l’échelle de l’entreprise. L’obtention des points de vue de tous les membres de l’équipe permettra d’élargir les choix stratégiques d’un produit et à celui-ci d’avoir plus de succès.
Tâche no 3 : Orientation pour la Présentation de drogue nouvelle (PDN)
Responsabilité décisionnelle : Affaires réglementaires
Résultat recherché : Planifier et exécuter une réunion préparatoire à la PDN et faire un suivi auprès de la Division des produits thérapeutiques (DPT) pour obtenir une orientation sur le programme clinique et le dossier de présentation.
Recommandations en matière de planification :
Pour qu’un produit ait les meilleures chances de succès, il est primordial de concentrer les efforts sur l’obtention d’une approbation rapide de la DPT. Le dossier de présentation de la PDN est la partie la plus importante du lancement. Il n’y aura tout simplement pas de lancement si le dossier de présentation, l’examen et l’approbation du produit n’ont pas lieu dans des délais opportuns.
Le travail préparatoire de la PDN doit être minutieux en tous points; tous les renseignements et toute la documentation doivent être assemblés avec soin conformément aux exigences de la DPT. Les renseignements clés de cette documentation sont : l’efficacité et l’innocuité, la chimie et la fabrication, les données non cliniques et cliniques. Le stade préclinique de la recherche commence avant les essais cliniques pour démontrer l’innocuité du médicament. Les essais cliniques visent à tester le médicament chez l’humain.
Il y a peu de règles absolues pour l’élaboration d’une PDN, cependant certaines lignes directrices pertinentes peuvent contribuer à en faciliter la préparation. Les lignes directrices de la DPT sont accessibles dans le site Web de Santé Canada (mots clés : Santé Canada) ou en s’adressant directement à la DPT, Bureau de l’évaluation des produits pharmaceutiques, immeuble des Finances, Pré Tunney, Ottawa, Ontario, K1A 1B6.
Avant que ne commence la préparation de la PDN, déterminez si les lignes directrices de la Food and Drug Administration (FDA) ou de l’ICH peuvent être pertinentes. Dans certains cas, la FDA des États-Unis a davantage de lignes directrices réglementaires que la DPT. Vous devriez les examiner pour en évaluer la pertinence. La Conférence internationale sur l’harmonisation (ICH) travaille à la normalisation des exigences réglementaires en Europe, au Japon et aux États-Unis et la DPT a adopté ces lignes directrices. Il est courant de tenir une réunion préparatoire à la PDN avec les évaluateurs de la DPT avant d’aller trop loin dans l’élaboration de la PDN.
Créez une trousse de préparation à la réunion contenant un résumé de toutes les données cliniques et techniques qui serviront à la préparation de la PDN. Les membres des services des Affaires réglementaires et médicales présenteront les données qui seront soumises à l’appui de la PDN. Les dossiers ou les préoccupations non résolus qui sont soulevés par les examinateurs peuvent être éclaircis et négociés pendant la réunion.
Tâche no 4 : Élaboration de la monographie du produit
Responsabilité décisionnelle : Affaires réglementaires, PNP, Affaires médicales et Marketing
Résultat recherché : Une monographie de produit (MP) en harmonie avec les objectifs de commercialisation.
Recommandations en matière de planification :
L’élaboration d’une monographie de produit bien conçue est essentielle au succès d’un produit, étant donné que le texte de la monographie de produit influence le degré de réussite ou d’échec d’un nouveau produit. Faites tous les efforts possibles pour inclure des renseignements pertinents, y compris tous les renseignements sur la maladie principale ainsi que les messages de la marque dans la monographie du produit, car ceux-ci sont essentiels aux fins de promotions futures.
Ce sont les services des Affaires réglementaires et des Affaires médicales qui sont responsables de la préparation de la PDN, avec l’apport des équipes de Planification d’un nouveau produit (PNP) et du Marketing quant aux renseignements essentiels concernant la capacité concurrentielle du nouveau produit.
Avant de préparer la monographie du produit, évaluez les produits concurrents afin de déterminer les lignes directrices sur l’étiquetage de la classe de médicament qui sont susceptibles de s’appliquer directement au nouveau produit. Examinez les monographies des produits concurrents sur les plans du style et du contenu, particulièrement celles qui présentent les avantages concurrentiels précis des produits. Tous les énoncés et toutes les allégations de la monographie de produit contenus dans le dossier de présentation doivent être appuyés par de la documentation et des données. Le défaut de fournir des documents de soutien suffisants peut retarder les approbations. Une autre suggestion précieuse consiste à obtenir les points de vue des guides d’opinion (KOL) sur les principaux moteurs de prescription dans le domaine thérapeutique du produit, ainsi qu’à inclure une différenciation des produits afin de soutenir les efforts promotionnels futurs. Il est recommandé d’engager un consultant pour fournir une analyse des monographies des produits concurrents. La personne qui effectue l’analyse des monographies de produits doit posséder des compétences sur le plan stratégique pour reconnaître les possibilités promotionnelles des concurrents et le milieu promotionnel à long terme au Canada. La monographie de produit est le document concurrentiel le plus important du cycle de vie du produit.
Réflexions de l’auteur sur les lancements
Une monographie de produit appuyée par de bonnes références est vitale à la réussite promotionnelle d’un produit. Assurez-vous de vous projeter cinq à dix ans dans l’avenir pour déterminer où résident les possibilités promotionnelles de votre produit. Pour atteindre cet objectif, retenez les services d’un consultant externe en marketing expérimenté dans la réglementation et la commercialisation pour effectuer une évaluation et un examen concurrentiels approfondis des monographies de produits concurrents.
Tâche no 5 : Création d’un numéro de projet financier et de budgets de dépenses
Responsabilité décisionnelle : Service des finances
Résultat recherché : Créer un numéro de projet pour le produit, ainsi que le budget de dépenses et les codes budgétaires préliminaires.
Recommandations en matière de planification :
Sur le plan financier, il est prudent d’établir un numéro de projet afin de faire un suivi efficace des dépenses. Au moment de la transition du produit depuis le stade de développement commercial à l’équipe de lancement, il est important de calculer les estimations de dépenses préliminaires pour les trois à six prochains mois. Un numéro de projet, établi avec votre partenaire financier et tous les membres de l’équipe de lancement, permettra de suivre toutes les dépenses liées au produit. Même si des codes de produits finiront par être créés, il est important que toutes les dépenses à court terme soient affectées à un numéro de projet en vue d’une organisation rationnelle. Il est recommandé d’inclure, dès le début du processus, votre équipe des Finances à titre de partenaire important du développement du produit.
Tâche no 6 : Propriété intellectuelle : Confirmation des brevets et des droits de distribution pour le composé et la formulation
Responsabilité décisionnelle : Service juridique et équipe multidisciplinaire
Résultat recherché : Examen du brevet sur le plan de la propriété intellectuelle (PI).
Recommandations en matière de planification :
Déposez vos demandes de brevets à un stade précoce du processus pour protéger l’exclusivité du marché. Dans le cadre de l’examen des débouchés commerciaux, incluez une analyse du statut du brevet pour le nouveau produit, qu’il provienne de la R et D interne ou d’un accord de licence.
Quelques éléments clés à envisager :
- Examinez le Registre des brevets des États-Unis (Orange Book) pour vérifier s’il y a des numéros d’enregistrement de brevets et, au besoin, rendez compte de tout renseignement au sujet du brevet reçu de vos partenaires de licence.
- Toutes les posologies et tous les formats utilisés dans des essais cliniques doivent être protégés par des brevets.
- Confirmez le statut du brevet auprès des agents de brevets de votre entreprise.
- Les brevets qui portent sur un nouveau médicament devraient également être inscrits auprès de Santé Canada. Cette étape n’est pas obligatoire, mais elle devrait être envisagée comme facteur dissuasif contre les demandes prématurées des génériques. Il est recommandé d’inscrire tous les brevets émis auprès de Santé Canada lorsque la PDN est soumise pour examen.
- Vérifiez bien s’il y a des brevets concurrentiels qui devraient inquiéter votre entreprise.
Il faut détenir des brevets tant pour les composés que pour les formulations. À ce stade-ci, l’ingrédient pharmaceutique actif (IPA) ou le composé du nouveau produit devrait déjà être protégé par un brevet. Santé Canada maintient un Registre des brevets, en lien avec les Avis de conformité, ce qui oblige tout fabricant de génériques, avant le dépôt d’une présentation abrégée de drogue nouvelle, à en informer le détenteur de brevet au moyen d’un Avis d’allégation. Le fabricant innovateur peut alors intenter une action en justice pour empêcher l’émission d’un AC au fabricant de génériques pendant que le brevet est en vigueur. L’inscription d’un brevet au registre des brevets de Santé Canada fait l’objet de conditions strictes.
Lorsque des brevets sont enregistrés,
l’équipe des Affaires juridiques doit vérifier que :
- Seuls les brevets pour un médicament ou une nouvelle utilisation d’un médicament peuvent être enregistrés (les brevets de procédés chimiques ne peuvent pas être enregistrés auprès de Santé Canada).
- Toutes les inventions relatives au produit font l’objet de demandes de brevets qui sont déposées avant la rédaction de la PDN.
- Tous les brevets émis doivent être présentés pour être enregistrés en même temps que la PDN.
- Tous les brevets relatifs au produit doivent être soumis de nouveau pour enregistrement chaque fois qu’une PDN supplémentaire est faite.
- Tout nouveau brevet émis après la soumission du dossier de présentation de la PDN doit être présenté pour enregistrement dans les trente jours qui suivent son émission.
Le statut de la propriété intellectuelle (PI) définit la structure du cycle de vie de la marque. Il y a plusieurs revendications qui permettent de protéger par brevet la propriété intellectuelle, par exemple :
Revendication pour l’ingrédient médicinal — cette revendication est faite dans le brevet, que sa nature soit chimique ou biologique, lorsque l’ingrédient a été préparé ou produit selon les méthodes ou procédés de fabrication qui sont décrits et revendiqués dans le brevet ou par leurs équivalents chimiques évidents. Cette revendication comprend également une revendication pour des polymorphes différents de l’ingrédient médicinal, mais elle n’inclut pas les formes chimiques différentes de l’ingrédient médicinal.
Revendication pour la formulation — une revendication pour une substance composée d’un mélange d’ingrédients médicinaux et non médicinaux dans un médicament administré aux patients sous une forme posologique particulière.
Revendication pour la forme posologique — une revendication pour un système d’administration d’un ingrédient médicinal dans un médicament ou pour une formulation d’un médicament dont la portée comprend cet ingrédient médicinal ou cette formulation.
Revendication pour l’utilisation de l’ingrédient médicinal — une revendication pour l’utilisation de l’ingrédient à des fins de diagnostic, de traitement, d’atténuation ou de prévention d’une maladie, d’un trouble ou d’un état physique anormal ou pour ses symptômes.
Le tableau ci-après présente un exemple d’un résumé des revendications du brevet pour le produit X.

Les droits de distribution pour un produit sous licence définissent le territoire géographique pour la vente et la commercialisation d’un produit. Il est important d’en comprendre les restrictions, comme, par exemple, la fixation du nombre de visites par année.
Tâche no 7 : Marques de commerce, image de marque et nom du produit
Responsabilité décisionnelle : Services des Affaires juridiques, du Développement commercial, des Affaires réglementaires et PNP
Résultat recherché : Avoir établi le nom de la marque, déterminé les marques de commerce et les avoir enregistrées.
Recommandations en matière de planification :
Soyez certains d’apposer les marques de commerce appropriées sur toute la documentation promotionnelle. Toutes les marques de commerce doivent être clairement reconnaissables par le symbole MC. Après que la marque a été enregistrée, le symbole MC est habituellement remplacé par le symbole MD pour « marque déposée »”. Les marques de commerce servent à identifier les produits et à les distinguer des produits concurrents.
Il existe trois types généraux de marques de commerce, et les trois peuvent s’appliquer à votre nouveau produit :
- Mot servant de marque — habituellement un nom de marque. (c.-à-d. Mercedes-Benz, SUNOCO)
- Dessin de marque — ou logo. (c.-à-d. la croix de Bayer, l’étoile à trois branches de Mercedes-Benz)
- Habillage commercial — la forme et la couleur d’un comprimé ou d’une capsule; la forme, la configuration et la couleur d’un dispositif de distribution. (p. ex., bouteille de Coca-Cola)
Les clients reconnaîtront un produit à partir de caractéristiques telles que son nom, sa couleur, sa forme et sa taille, et ces marques de commerce sont perçues comme des indices de qualité. La direction du Marketing doit participer au choix des marques de commerce pour le produit et ces marques de commerce doivent être enregistrées auprès de l’Office de la propriété intellectuelle du Canada.
L’enregistrement d’une marque de commerce donne au fabricant le droit exclusif d’utiliser cette marque de commerce dans tout le Canada. Le processus de demande d’enregistrement s’étale souvent sur au moins un an, c’est pourquoi il est important de déposer une demande à ce stade du processus.
L’Office canadien de la propriété intellectuelle a publié un excellent guide pour vous aider à comprendre la sélection et l’utilisation des marques de commerce. Ce guide est accessible dans le site Web de l’Office (mots clés : propriété intellectuelle du Canada – marques de commerce).
Réflexions de l’auteur sur les lancements
Votre équipe du service des Communications doit respecter vos directives relatives à la marque de commerce, sinon vous risquez d’affaiblir votre marque de commerce. Dans une entreprise pour laquelle j’ai travaillé, les anciens spécialistes du marketing avaient négligé d’identifier des marques de commerce au moyen des symboles, ce qui a donné le champ libre aux concurrents pour utiliser une revendication de marque de commerce similaire. La force de notre revendication a été affaiblie par l’absence d’une utilisation diligente du symbole MC, malgré notre demande d’enregistrement de la marque de commerce. La conservation de notre marque de commerce nous aurait permis de créer une différence concurrentielle sur le marché, ce que nous avons perdu en raison de notre négligence dans nos publicités et notre matériel promotionnel. Assurez-vous de toujours identifier votre marque de commerce, particulièrement avant la réception de votre certificat d’enregistrement (marque déposée).
Tâche no 8 : Établissement des principaux jalons du lancement
Responsabilité décisionnelle : Chefs des secteurs fonctionnels et Équipe de lancement
Résultat recherché : Avoir déterminé des jalons spécifiques, réalisables et mesurables de la réussite du lancement.
Recommandations en matière de planification :
Établissez des objectifs stimulants au niveau de la haute direction et associez les résultats aux évaluations de rendement des personnes et des équipes. L’engagement à réaliser les principaux jalons pour la marque est crucial, car ces jalons sont recommandés par l’équipe multidisciplinaire de lancement avec l’approbation finale des chefs des secteurs fonctionnels et du directeur général. Comme bon nombre de ces jalons sont des objectifs ambitieux, ils devront être soutenus et harmonisés par la haute direction.
Exemples de jalons d’un lancement :
- Dates cibles des Affaires réglementaires : préparer le dossier de la PDN en vue de la soumission du dossier de présentation, organiser une réunion préparatoire à la soumission du dossier de présentation avec la DPT et obtenir l’AC dans un délai de X jours après la réception du mandat.
- Développement du marché : assurer la formation de X % des guides d’opinion au moyen du programme de formation des conférenciers avant la réception de l’AC.
- Équipe des agents de liaison médicale et scientifique : assurer la formation et le déploiement des agents LMS dans un délai de X mois avant l’obtention de l’AC.
- Programme d’essais cliniques de phase IV lancé au moment de l’obtention de l’AC.
- Équipe de vente affectée d’ici le X (date) avant l’obtention de l’AC et formée au moment de l’obtention de l’AC.
- Produit commercial prêt à être expédié aux pharmaciens X jours après l’obtention de l’AC.
- Échantillons prêts à être expédiés aux représentants dans un délai de X jours après l’obtention de l’AC.
- Obtention de l’accès aux marchés dans les provinces ciblées : ON, AB, C.-B. et QC dans un délai de X jours avant le lancement.
Réflexions de l’auteur sur les lancements
L’équipe de direction a établi des jalons de lancement énergiques afin de préparer le lancement d’un médicament gastro-intestinal. Un des jalons consistait à lancer le médicament dans les jours suivant l’obtention de l’AC. Cet objectif a été dépassé et l’entreprise a pu lancer le médicament dès le lendemain de l’obtention de l’AC grâce au travail d’équipe concentré sur un objectif commun.
Tâche no 9 : Consultation du Programme commun d’évaluation des médicaments (PCEM)
Responsabilité décisionnelle : Accès aux marchés
Résultat recherché : Obtenir l’opinion du Programme commun d’évaluation des médicaments (PCEM) concernant les lacunes en matière de données dans le message sur la valeur économique de la marque.
Recommandations en matière de planification :
Les consultations avec le PCEM commencent au début du processus afin de déterminer les lacunes en matière de données dans le processus d’inscription aux listes de médicaments remboursés; ces consultations ont de grandes répercussions sur les décisions relatives à l’inscription des produits sur les listes de médicaments des provinces et sur l’accès subséquent au marché. De façon réaliste, il est peu vraisemblable que le temps imparti permette de mener de nouveaux essais cliniques dans des délais suffisants pour la présentation du dossier au PCEM, mais il sera toujours possible d’effectuer une nouvelle analyse des données existantes et une seconde analyse ou une nouvelle rédaction des messages économiques possibles.
Contexte
À l’Agence canadienne des médicaments et des technologies de la santé (ACMTS), le Programme commun d’évaluation des médicaments est un processus pancanadien pour la tenue d’examens objectifs et rigoureux du rapport coût-efficacité d’un médicament et des données probantes cliniques et fondées sur les patients. Le PCEM fait également des recommandations sur l’inscription des médicaments sur les listes de médicaments remboursés par les régimes publics d’assurance-médicaments du Canada (sauf au Québec).
Pour de plus amples renseignements, veuillez consulter le site Web de l’ACMTS (mot-clé : ACMTS).
Tâche no 10 : Élaboration et déclenchement du Plan d’analyse du marché
Responsabilité décisionnelle : Études de marché
Résultat recherché : Obtenir une vue de 360 degrés des débouchés du marché.
Recommandations en matière de planification :
Effectuer un examen concurrentiel détaillé du marché, notamment :
- Analyse secondaire des ordonnances et des ventes du marché (données d’IMS CompuScript, CDH et Brogan).
- Ordonnances par groupes de spécialités (pour déterminer quels spécialistes, le cas échéant, jouent un rôle actif sur le marché).
- Algorithmes de traitement actuels par indication.
- Contexte actuel du remboursement des médicaments, ce qui peut inclure la fixation concurrentielle des prix et les méthodes de distribution, le partage public/privé du remboursement par indication cible, le statut des concurrents en matière de remboursement et le statut à l’égard de la liste des médicaments remboursés des hôpitaux, le cas échéant.
- Renseignements de veille concurrentielle sur les principaux concurrents, entre autres sur les brevets et les promotions et, si possible, sur les concurrents futurs.
- Examen et sélection des meilleurs analogues à des fins prévisionnelles.
- Recherche pour l’évaluation qualitative préliminaire des débouchés auprès des prescripteurs (petit échantillon de spécialités pertinentes) et des guides d’opinion.
Cet examen complet permettra de :
- déterminer des tendances sur le plan des attitudes et des comportements des clients sur le marché;
- documenter les forces et les faiblesses perçues des produits et des traitements existants;
- reconnaître les besoins existants non satisfaits et les besoins émergents du marché (patients, médecins, pharmaciens et payeurs);
- obtenir la réaction des clients aux concepts préliminaires du produit.
Il est impératif que l’analyse du marché soit effectuée au bon moment afin d’assurer la meilleure valeur au développement du produit.
Réflexions de l’auteur sur les lancements
Je suggère une démarche unique pour veiller à ce que l’équipe commerciale comprenne l’importance de la planification des études de marché. Demandez à votre équipe d’analystes du marché de fournir à l’équipe de lancement un survol des stades de l’étude du marché en fonction des besoins du produit à divers stades de son développement. Entre autres avantages, cela permet d’éliminer les dépenses redondantes.
Tâche no 11 : Première évaluation commerciale détaillée
Responsabilité décisionnelle : Équipes de la PNP et de lancement
Résultat recherché : Une évaluation commerciale approfondie des débouchés commerciaux et du classement de la priorité de la marque.
Recommandations en matière de planification :
Avant de prendre la décision de donner un « feu vert » ou un « feu rouge » au lancement pendant le point de décision stratégique no 1, les équipes de PNP et de lancement doivent effectuer une première évaluation complète du potentiel de la marque, ce qui déterminera la taille du lancement, les enjeux importants et s’il s’agit d’un débouché qui cible les omnipraticiens ou les spécialistes.
Réflexions de l’auteur sur les lancements
Je recommande fortement de développer au moins votre évaluation commerciale et votre plan stratégique sur cinq ans sous forme de textes suivis, plutôt que sous forme d’une présentation PowerPoint plus désordonnée. Les plans sur PowerPoint ne permettent pas de saisir un contexte adéquat pour référence ultérieure. La valeur d’un document suivi provient du contexte détaillé de la prise de décision, lequel peut être utile par la suite. Nous savons tous qu’il y a un roulement de personnel rapide dans de nombreuses entreprises en raison de promotions et d’autres possibilités. Un document détaillé permettra de noter les convictions et les hypothèses. Si le temps et les ressources posent un problème, embauchez un consultant en planification stratégique qui apportera son soutien à cette activité utile.
Tâche no 12 : Sensibilisation au lancement à l’échelle de l’entreprise
Responsabilité décisionnelle : Équipe de LNP et Communications de l’entreprise
Résultat recherché : Créer une sensibilisation au nouveau produit et au type de patients traités.
Recommandations en matière de planification :
Après avoir terminé le point de décision stratégique no 1, l’équipe devra travailler en partenariat avec l’équipe interne des Communications de l’entreprise pour créer le message approprié à l’interne. Une réunion inaugurale au siège social peut être une initiative importante pour susciter de l’enthousiasme. Cette réunion permettra de sensibiliser le personnel aux débouchés du nouveau produit, de susciter de l’enthousiasme et d’obtenir le soutien du personnel pendant les vingt-et-un prochains mois avant le lancement.
Réflexions de l’auteur sur les lancements
À chacun de mes lancements, j’ai offert des « séances de discussion ouverte sur le lancement de produit » pour faciliter les communications au sein d’une entreprise. Ces réunions sont une occasion de présenter votre produit à toute l’entreprise et d’obtenir du soutien afin d’améliorer les soins aux patients. La tenue régulière de ces réunions permet d’accroître le soutien et l’enthousiasme et d’assurer le suivi de l’évolution du produit. Ces réunions représentent également une occasion d’offrir une belle visibilité à votre équipe de lancement à des fins de perfectionnement professionnel.
Tâche no 13 : Stratégie de fixation des prix : Plan de fixation des prix et d’accès aux marchés, confirmation de la stratégie mondiale en matière de prix et de la fourchette de prix
Responsabilité décisionnelle : Accès aux marchés
Résultat recherché : Tenir des réunions avec le CEPMB pour déterminer les prix comparables et les tests de prix, et prévoir des réunions avec le PCEM et les payeurs provinciaux au sujet de la stratégie de fixation des prix dans le but d’optimiser l’accès aux marchés et la valeur du produit.
Recommandations en matière de planification :
Faites de l’accès aux marchés une priorité parce que c’est probablement la variable la plus importante du cycle de vie d’un produit, depuis sa mise au point jusqu’à la négociation d’un contrat exclusif en réponse à un appel d’offres après la mise en marché de produits génériques.
La stratégie mondiale en matière de prix est un autre facteur important à prendre en compte dans ce domaine. Nous n’avons plus la liberté que nous avions autrefois pour un lancement mondial de produit. Les restrictions en matière de prix, y compris l’établissement de prix de référence, les limites en matière de profits et les réductions de prix ont créé un marché mondial qui doit composer avec de plus en plus de contraintes au niveau des prix. Un lancement dans un pays peut avoir des ramifications immédiates dans d’autres pays et les décisions en matière de prix peuvent avoir des répercussions sur d’autres marchés malgré les meilleurs efforts de l’entreprise. Dans ce marché mondial de plus en plus complexe, les entreprises doivent utiliser des analyses de segmentation du marché, les recherches sur les résultats cliniques et sur la santé, l’évaluation du commerce parallèle, les analyses politique, économique, sociale et technologique (PEST), ainsi que l’analyse de la demande afin de créer une stratégie mondiale coordonnée en matière de prix qui permettra de prévoir les difficultés sur le plan réglementaire. Même si elle est extrêmement difficile à créer, une stratégie mondiale de lancement efficace et exhaustive fait plus qu’en justifier les coûts.
RÉSUMÉ DU POINT DE DÉCISION STRATÉGIQUE NO 1
L’une des premières étapes du lancement d’un produit consiste à déterminer la priorité de ce produit au sein de l’entreprise. Cette priorité est fondée sur la valeur des ventes potentielles du produit et sur l’investissement requis pour assurer la réussite du lancement. L’évaluation commerciale détaillée terminée à ce stade donne à l’entreprise les renseignements dont elle a besoin pour prendre des décisions de « feu vert » ou de « feu rouge » sur le marché. Si le produit obtient un « feu rouge », il faut poser les questions suivantes : Que peut-on faire pour qu’il devienne un « feu vert »? Quel plan faut-il mettre en oeuvre pour réaliser cet objectif? Des ressources considérables sont investies dans la recherche et le développement, ou l’acquisition d’un produit sous licence, et l’équipe de lancement doit trouver un moyen de réussir la mise en marché de ce produit.
Pour terminer le Point de décision stratégique no 1, il faut réaliser les étapes suivantes :
- Le produit a été officiellement transmis à l’équipe de Planification du nouveau produit (PNP).
- Le chef d’équipe de Lancement de nouveau produit (LNP) et ses membres sont choisis et se réunissent régulièrement.
- Les codes de projet de la marque et un budget préliminaire des dépenses sont créés.
- Une orientation sur la Présentation de drogue nouvelle (PDN) a été reçue et la monographie du produit est rédigée.
- Les brevets et les marques de commerce canadiens sont enregistrés.
- La première évaluation commerciale détaillée est terminée.
- L’évaluation des prévisions et des profits et pertes a été faite.
- Les objectifs du lancement ont été établis et les paramètres sont définis.
Ces jalons étant atteints, l’équipe de LNP se situe au Point de décision stratégique no 1. À présent, avec la haute direction, l’équipe doit évaluer :
- Feu vert/Feu rouge : Que faut-il faire pour que la marque devienne un « Feu vert »?
- Recommandations quant à la priorité de la marque : A/B/C
- Principaux enjeux de la marque
À ce stade, un feu rouge pur et simple est peu probable, compte tenu de la décision initiale d’un « feu vert » vingt-quatre mois avant le lancement. Pourtant, il reste encore des enjeux importants à résoudre honnêtement, comme les lacunes dans le profil du produit qui nécessitent des études ou des analyses supplémentaires. L’équipe doit évaluer le niveau de priorité de la marque pour aider l’entreprise à commander sa charge de travail.
Les paramètres relatifs aux recommandations comprennent :
- La taille du débouché du marché.
- L’attrait du composé : y compris son rapport coût/efficacité (prix/remboursement)
- Le risque et la probabilité de réussite.
- Les coûts prévus et le rendement du capital investi.
- La correspondance thérapeutique avec les priorités de l’entreprise, par exemple la spécification de soins primaires ou de spécialité.
Avec la résolution des éléments du Point de décision stratégique no 1 : Développement de l’entreprise et amorce de toutes les tâches, l’équipe de LNP est prête à passer au Point de décision stratégique no 2 : Développement du produit.
Réflexions de l’auteur sur les lancements
Lorsque vous créez vos outils de communication, soyez conscient des délais requis pour la traduction vers le français. La traduction de l’anglais au français d’une fiche posologique peut être faite en quelques jours; par contre, il faut jusqu’à 6 semaines pour traduire une monographie de produit. Insérez les délais de traduction dans votre horizon de planification.
Module 1 : Autoévaluation
Q1. Indiquez parmi les réponses suivantes celle qui décrit le mieux le but du classement de la priorité d’une marque.
a) Positionner cette marque de façon prioritaire parmi les autres projets et affecter les ressources appropriées au débouché commercial.
b) Déterminer le degré de rapidité à accorder au lancement de la marque comparativement à d’autres marques.
c) Déterminer les marques qui ont besoin d’une équipe de lancement multidisciplinaire.
Q2. Énumérez trois critères de classement de la priorité d’une marque qui aident à déterminer quelle priorité, et par conséquent quelles ressources, l’entreprise doit affecter à plusieurs marques au sein de l’entreprise.
1. ____________________________
2. ____________________________
3. ____________________________
Q3. Parmi les réponses suivantes, indiquez celle qui est recommandée pour la planification d’une Présentation de drogue nouvelle (PDN).
a) Dans le site Web de Santé Canada, consultez les lignes directrices de la DPT qui pourraient être pertinentes à la PDN.
b) Vérifiez la pertinence des lignes directrices de la FDA et de l’ICH relativement à la PDN.
c) A et B
Q4. Lequel des énoncés suivants n’est PAS une caractéristique d’une monographie de produit bien conçue?
a) Rédigée méticuleusement avec une vision à long terme des possibilités promotionnelles du produit dans cinq à dix ans.
b) Rédigée à titre de document réglementaire avec peu de contribution du service du Marketing.
c) Examinée par un consultant externe sur le plan de l’analyse concurrentielle.
Q5. Une « revendication pour l’ingrédient médicinal » est un type de revendication qui permet de protéger par brevet la propriété intellectuelle. Nommez-en trois autres :
1. ________________________________
2. ________________________________
3. ________________________________
Q6. Lequel des énoncés suivants décrit le mieux le type de marque de commerce appelé « habillage commercial »?
a) La combinaison du logo et du nom de la marque.
b) Les symboles de marque de commerce qui suivent le nom et le logo de marque lorsqu’ils apparaissent sur des pièces promotionnelles.
c) La forme et la couleur d’un comprimé ou d’une capsule; la forme, la configuration et la couleur d’un dispositif de distribution.
Q7. Quelles sont les trois caractéristiques qui doivent décrire tous les jalons importants d’un lancement?
1. _________________________________
2. _________________________________
3. _________________________________
Q8. Nommez le processus et l’organisme qui effectue des évaluations rigoureuses du rapport coût-efficacité d’un médicament ainsi que des données probantes cliniques et fondées sur les patients :
__________________________________
__________________________________
Module 1 : Réponses au questionnaire d’autoévaluation
Q1.
a) Positionner cette marque de façon prioritaire parmi les autres projets et affecter les ressources appropriées au débouché commercial.
Q2. (donnez 3 critères sur 5) :
1. Taille du marché
2. Attrait du profil du produit
3. Valeur actuelle nette sur cinq ans
4. Coût d’entrée
5. Priorités de l’entreprise
Q3.
c) A et B
Q4.
b. Rédigée à titre de document réglementaire avec peu de contribution du service du Marketing n’est pas une caractéristique d’une monographie de produit bien conçue. Le Marketing doit contribuer à la rédaction de la MP.
Q5.
1. Revendication pour la formulation
2. Revendication pour la forme posologique
3. Revendication pour l’utilisation de l’ingrédient médicinal
Q6.
c) La forme et la couleur d’un comprimé ou d’une capsule; la forme, la configuration et la couleur d’un dispositif de distribution.
Q7.
a) Spécifique
b) Réalisable
c) Mesurable
Q8.
Le Programme commun d’évaluation des médicaments est le nom du processus dirigé par l’Agence canadienne des médicaments et des technologies de la santé (ACMTS).
